Viele Hersteller haben sich lange gefragt, ob die Zeit zur Umsetzung der EU-Verordnung für Medizinprodukte (MDR) nicht viel zu kurz ist. Der Übergangszeitraum betrug ursprünglich 3 Jahre. Die Situation ist besonders prekär da viele Voraussetzungen für die Umsetzung (z.B. Gemeinsame Spezifikationen und wichtige Richtlinien) immer noch fehlen. Selbst die zentrale Datenbank EUDAMED wird erst mit einer Verspätung von mindestens 2 Jahren online gehen. Erschwerend kommt die schleppende Neuzertifizierung der benannten Stellen und deren viel zu geringe Anzahl hinzu.
Bis Mai 2019 haben lediglich 39 der aktuell 58 Benannten Stellen haben einen Antrag auf Neubenennung auf der Grundlage der MDR gestellt. Von diesen 39 Antragstellern haben derzeit (Stand 17.02.2021) 19 die Zertifizierung erfolgreich abgeschlossen [1].
Das Chaos ist also vorprogrammiert!
Jetzt haben wir ein Jahr mehr – Reicht die Zeit?
Der Bundesverband der Pharmazeutischen Industrie (BPI e.V.) hatte angesichts der COVID-19-Pandemie bereits am 13. März 2020 ein MDR-Moratorium gefordert. Am 24. April wurde die Änderung im
EU-Amtsblatt veröffentlicht und ist damit in Kraft getreten. Der Geltungsbeginn der MDR wird um ein Jahr zu verschoben, d.h. neuer Stichtag ist der 26. Mai 2021 [2]. Begründet hat die EU Kommission diesen Vorschlag mit den COVID-19 bedingten Herausforderungen und der Komplexität der MDR. Der für die Förderung der europäischen Lebensweise zuständige Vizepräsident Margaritis Schinas erklärte dazu [3]: „Ich bin erfreut, dass das Europäische Parlament und der Rat den Vorschlag zur Verschiebung des Geltungsbeginns der Verordnung über Medizinprodukte um ein Jahr in Rekordzeit angenommen haben. Wir wollen unbedingt erreichen, dass unsere Medizinprodukte-Hersteller ihre gesamte Energie dort investieren, wo wir sie am dringendsten brauchen: In die Bekämpfung der Pandemie. Die Europäische Union wird alles in ihrer Macht Stehende tun, um unsere Gesundheitssysteme in dieser Notlage zu unterstützen.“
Sicherlich sind die Herausforderungen durch die Corona-Krise ein gutes Argument für die Verlängerung. Aber wenn wir ehrlich sind, hätten auch ohne diese Krise die meisten Unternehmen den Termin nicht einhalten können. Die Folge wäre gewesen, dass keine Produkte oder nicht nach der neuen Verordnung zertifizierte Produkte für Europa zur Verfügung stehen würden.
Jetzt haben wir ein Jahr mehr – Reicht die Zeit?
Damit sieht die Timeline wie in Abbildung 1 dargestellt aus:
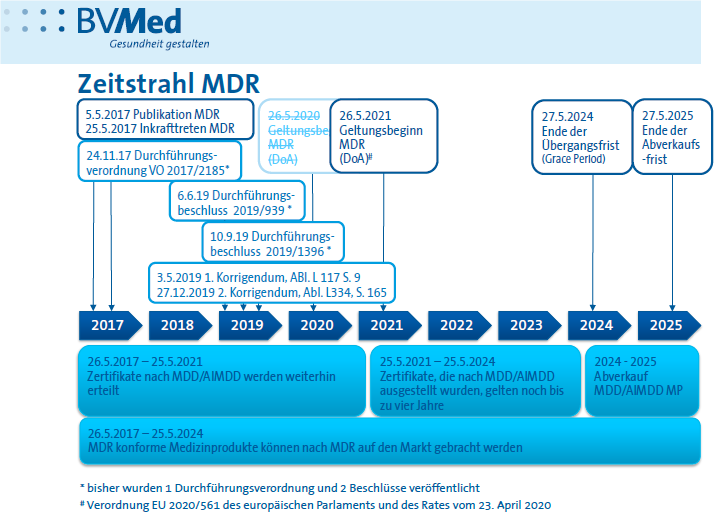
Rückblick: Die wichtigsten Änderungen der MDR
Die neue EU-Medizinprodukteverordnung (MDR 2017/745) ersetzt die aktuelle Medizinprodukterichtlinie (93/42/EWG) sowie die Richtlinie über aktive implantierbare medizinische Geräte (90/385/EWG).
Die Verordnung über Medizinprodukte unterscheidet sich in mehreren Punkten gravierend von den aktuellen EU-Richtlinien für Medizinprodukte und aktive implantierbare medizinische Geräte. Zu den wichtigsten Änderungen zählen (siehe Abbildung 2):
Erweiterter Geltungsbereich
Die Definitionen für Medizinprodukte wurden erheblich erweitert und umfassen nun beispielsweise auch Produkte ohne medizinische Zweckbestimmung, wie z.B. farbige Kontaktlinsen.
Unique Device Identification (UDI)
Diese Anforderung soll die Rückverfolgbarkeit für Hersteller und Behörden vereinfachen und so den schnellen und effizienten Rückruf von Medizinprodukten ermöglichen, die ein Sicherheitsrisiko darstellen.
Europaweite Datenbank EUDAMED
Einführung einer elektronischen Datenbank zur Überwachung von Medizinprodukten über den gesamten Produktlebenszyklus.
Neue Klassifizierungsregeln
Es wurden neue Risikoklassen für einige Produktkategorien eingeführt. Durch die Anwendung der neuen Klassifizierungsregeln werden einige Produkte einer höheren Risikoklasse zugeordnet.
Regulatorisch verantwortliche Person
Die neue Verordnung definiert eine qualifizierte Person, die dafür zuständig ist, dass die Anforderungen der MDR erfüllt werden.
Klinische Prüfungen
Die MDR macht konkrete Angaben zur Art und Qualität von klinischen Prüfungen.
Strengere Anforderungen an Post-Market Surveillance (PMS)
In der MDR ist der PMS-Prozess als Teil des Qualitätsmanagementsystems aufgesetzt. Dieser muss der Risikoklasse und der Art des Produkts angemessen sein und gewährleisten, dass Daten über die Qualität, die Leistung und die Sicherheit eines Produkts während der gesamten Produktlebensdauer aktiv gesammelt und analysiert werden.
Technische Dokumentation z.B. Klinische Bewertung
Der Umfang der Dokumentation steigt durch die MDR erheblich, wodurch auch der Aufwand für die Hersteller deutlich zunimmt. Zur Zertifizierung ist in Zukunft zwingend eine Klinische Bewertung notwendig. In vielen Fällen erfordert sie eigene klinische Prüfungen.
Abbildung 2: Die wichtigsten Änderungen der MDR im Überblick [5].
Aufgeschoben ist nicht aufgehoben
Am 26. Mai dieses Jahres hätte es also soweit sein sollen: Der vielfach diskutierte, und mit Spannung erwartete Stichtag für die Ablösung der alten Richtlinie durch die MDR war schon in Reichweite. Nur etwa einen Monat vor dem Erreichen war das Ziel plötzlich wieder in weiter Ferne und all die Unsicherheit und die damit verbundenen Probleme waren weg. Zumindest für ein weiteres Jahr.
Vorerst bleibt alles beim Alten – wenigstens bis zum 26. Mai 2021. Zeit zum Zurücklehnen? Wahrscheinlich nicht, aber definitiv Zeit Chancen zu nutzen, welche sich nun unverhofft ergeben haben.
Nutzen Sie die Zeit
Auch wenn noch etwas Zeit ist, bis die Frist zur Umsetzung der EU-Medizinprodukte-Verordnung abläuft: Sie sollten jetzt beginnen, falls Sie dies nicht längst getan haben. Denn die vielfältigen Anforderungen sind komplex und aufwendig. Planen Sie deshalb ausreichend Zeit ein, um die Einhaltung bis zum neuen Stichtag gewährleisten zu können.
Denn mit der Verschiebung des Stichtags um ein weiteres Jahr ergeben sich nun plötzlich neue Möglichkeiten, nicht nur für am Markt etablierte Hersteller auch für neue Marktteilnehmer und Startups.
Die MDR-Verschiebung ist ein Geschenk. Umso wichtiger ist es, dieses jetzt anzunehmen und die zusätzliche Zeit gewinnbringend zu nutzen.
Referenzen
- https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=34.
- VERORDNUNG (EU) 2020/558 DES EUROPÄISCHEN PARLAMENTS UND DES RATES vom 23. April 2020. Amtsblatt der Europäischen Union – L 130. 24. April 2020;63. Jahrgang.
- Verordnung über Medizinprodukte: Kommission begrüßt Unterstützung des Rates dafür, vorrangig das Coronavirus zu bekämpfen. Europäische Kommission – Pressemitteilung. 23. April 2020.
- https://www.bvmed.de/de/recht/eu-medizinprodukte-verordnung-mdr.
- https://www.tuv.com/germany/de/eu-medizinprodukteverordnung-mdr-2017-745.html
Die Autorinnen

Dr. Mette Stoedter | Lead Medical Writing
Als promovierte Biotechnologin im Fachbereich Medizinische Wissenschaften an der Charité Berlin schreibt Mette Stoedter seit 3 Jahren Klinische Bewertungen.

Dr. Christine Stock | Lead Medical Writing
Seit 3 Jahren erstellt die promovierte Biotechnologin Christine Stock bei der Dr. Notghi Contract Research GmbH Klinische Bewertungen für Medizinprodukte der Risikoklassen I – IIb.




